Autor:
Judy Howell
Data Utworzenia:
2 Lipiec 2021
Data Aktualizacji:
21 Czerwiec 2024

Zawartość
- Do kroku
- Część 1 z 2: Znajdowanie liczby atomowej
- Część 2 z 2: Znajdowanie powiązanych informacji
- Porady
Liczba atomowa pierwiastka to liczba protonów w jądrze pojedynczego atomu tego pierwiastka. Liczba atomowa pierwiastka lub izotopu nie zmienia się, więc możesz użyć liczby atomowej do obliczenia innych właściwości pierwiastka lub izotopu, takich jak liczba neutronów.
Do kroku
Część 1 z 2: Znajdowanie liczby atomowej
 Znajdź kopię układu okresowego. Możesz go znaleźć tutaj, jeśli go nie masz pod ręką. Każdy pierwiastek ma inną liczbę atomową, więc nie ma dostępnych szybkich i łatwych metod. Będziesz musiał albo znaleźć kopię układu okresowego, albo ją zapamiętać.
Znajdź kopię układu okresowego. Możesz go znaleźć tutaj, jeśli go nie masz pod ręką. Każdy pierwiastek ma inną liczbę atomową, więc nie ma dostępnych szybkich i łatwych metod. Będziesz musiał albo znaleźć kopię układu okresowego, albo ją zapamiętać. - Większość podręczników do chemii ma układ okresowy wydrukowany na wewnętrznej stronie okładki.
 Znajdź element, którego się uczysz. Większość okresowych tablic zawiera pełne nazwy różnych pierwiastków, a także ich symbole chemiczne (takie jak Hg dla rtęci). Jeśli masz problem ze znalezieniem pierwiastka, wyszukaj w Internecie „symbol chemiczny”, a po nim nazwę pierwiastka.
Znajdź element, którego się uczysz. Większość okresowych tablic zawiera pełne nazwy różnych pierwiastków, a także ich symbole chemiczne (takie jak Hg dla rtęci). Jeśli masz problem ze znalezieniem pierwiastka, wyszukaj w Internecie „symbol chemiczny”, a po nim nazwę pierwiastka.  Znajdź liczbę atomową. Liczba atomowa zwykle znajduje się w lewym lub prawym górnym rogu pudełka zawierającego element, ale może też znajdować się w innym miejscu w pudełku. Liczba atomowa jest zawsze liczbą całkowitą.
Znajdź liczbę atomową. Liczba atomowa zwykle znajduje się w lewym lub prawym górnym rogu pudełka zawierającego element, ale może też znajdować się w innym miejscu w pudełku. Liczba atomowa jest zawsze liczbą całkowitą. - Jeśli jest to liczba dziesiętna, prawdopodobnie patrzysz na masę atomową.
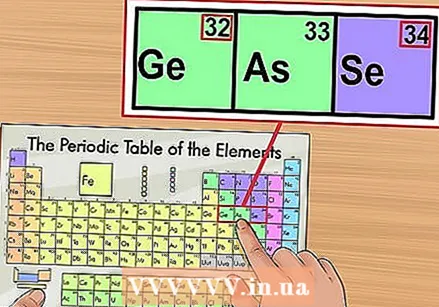 Sprawdź z sąsiednimi elementami. Układ okresowy jest uporządkowany według liczby atomowej. Jeśli liczba atomowa Twojego pierwiastka to „33”, to element po lewej stronie powinien mieć wartość „32”, a element po prawej stronie - „34”. Jeśli ta kolejność jest poprawna, to absolutnie znalazłeś liczbę atomową.
Sprawdź z sąsiednimi elementami. Układ okresowy jest uporządkowany według liczby atomowej. Jeśli liczba atomowa Twojego pierwiastka to „33”, to element po lewej stronie powinien mieć wartość „32”, a element po prawej stronie - „34”. Jeśli ta kolejność jest poprawna, to absolutnie znalazłeś liczbę atomową. - Po elementach 56 (bar) i 88 (rad) może znajdować się pusta przestrzeń. W rzeczywistości nie ma miejsca; elementy z liczbami atomowymi, które tam należą, znajdują się w dwóch rzędach poniżej reszty układu. Jedynym powodem, dla którego są tak rozdzielone, jest zmniejszenie szerokości układu okresowego.
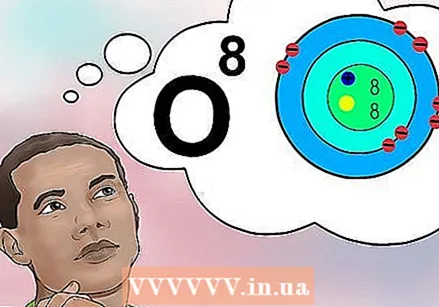 Zrozum, jaka jest liczba atomowa. Istnieje prosta definicja liczby atomowej pierwiastka: liczba protonów w jednym atomie tego pierwiastka. To jest podstawowa definicja elementu. Liczba protonów określa całkowity ładunek elektryczny jądra, który określa, ile elektronów może mieć atom. Ponieważ elektrony są odpowiedzialne za prawie wszystkie reakcje chemiczne, liczba atomowa pośrednio określa prawie wszystkie właściwości fizyczne i chemiczne pierwiastka.
Zrozum, jaka jest liczba atomowa. Istnieje prosta definicja liczby atomowej pierwiastka: liczba protonów w jednym atomie tego pierwiastka. To jest podstawowa definicja elementu. Liczba protonów określa całkowity ładunek elektryczny jądra, który określa, ile elektronów może mieć atom. Ponieważ elektrony są odpowiedzialne za prawie wszystkie reakcje chemiczne, liczba atomowa pośrednio określa prawie wszystkie właściwości fizyczne i chemiczne pierwiastka. - Innymi słowy, każdy atom z ośmioma protonami jest atomem tlenu. Dwa atomy tlenu mogą mieć różną liczbę neutronów lub (jeśli jeden jest jonem) inną liczbę elektronów, ale oba zawsze będą miały osiem protonów.
Część 2 z 2: Znajdowanie powiązanych informacji
 Znalezienie masy atomowej. Masa atomowa jest zwykle drukowana pod nazwą danego pierwiastka w układzie okresowym i jest zwykle obliczana z dokładnością do dwóch lub trzech miejsc po przecinku. Jest to średnia masa jednego atomu pierwiastka, dostosowana do tego, co prawdopodobnie znajdziesz w naturze. Liczba ta jest wyrażona w „atomowych jednostkach masy” (AMU (z angielskiego „atomic mass unit”)).
Znalezienie masy atomowej. Masa atomowa jest zwykle drukowana pod nazwą danego pierwiastka w układzie okresowym i jest zwykle obliczana z dokładnością do dwóch lub trzech miejsc po przecinku. Jest to średnia masa jednego atomu pierwiastka, dostosowana do tego, co prawdopodobnie znajdziesz w naturze. Liczba ta jest wyrażona w „atomowych jednostkach masy” (AMU (z angielskiego „atomic mass unit”)). - Niektórzy naukowcy używają terminu „względna masa atomowa” zamiast „masy atomowej”.
 Zrozumieć masę atomową. Masa atomowa jest pojęciem bardzo podobnym do pojęcia masy atomowej. Jedyna różnica polega na tym, że mówisz o konkretnym atomie, a nie o średniej z próbki testowej. Gram żelaza zawiera wiele atomów o masach nieznacznie różniących się od siebie, więc aby znaleźć średnią, należy szukać „wagi względnej”. Jeśli interesuje Cię tylko jeden konkretny atom żelaza, nie przejmujesz się średnią - interesuje Cię tylko dokładna masa tego konkretnego atomu.
Zrozumieć masę atomową. Masa atomowa jest pojęciem bardzo podobnym do pojęcia masy atomowej. Jedyna różnica polega na tym, że mówisz o konkretnym atomie, a nie o średniej z próbki testowej. Gram żelaza zawiera wiele atomów o masach nieznacznie różniących się od siebie, więc aby znaleźć średnią, należy szukać „wagi względnej”. Jeśli interesuje Cię tylko jeden konkretny atom żelaza, nie przejmujesz się średnią - interesuje Cię tylko dokładna masa tego konkretnego atomu. - W praktyce masa atomowa jest zwykle podawana już w przypadku problemów chemicznych, które dotyczą tylko jednego atomu. Zrozum tę koncepcję, aby nie być zaskoczonym, jeśli różni się ona od masy atomowej.
 Zaokrąglić do liczby masowej. Liczba masowa to całkowita liczba protonów i neutronów w jednym atomie pierwiastka. Możesz łatwo znaleźć tę liczbę: po prostu weź masę atomową podaną w układzie okresowym i zaokrąglij do najbliższej liczby całkowitej.
Zaokrąglić do liczby masowej. Liczba masowa to całkowita liczba protonów i neutronów w jednym atomie pierwiastka. Możesz łatwo znaleźć tę liczbę: po prostu weź masę atomową podaną w układzie okresowym i zaokrąglij do najbliższej liczby całkowitej. - To działa, ponieważ neutrony i protony mają około 1 AMU, a elektrony są bliskie 0 AMU. Precyzyjne pomiary są używane dla masy atomowej, aby uzyskać liczbę dziesiętną, ale interesują nas tylko liczby całkowite, które mówią nam o liczbie protonów i neutronów.
- Pamiętaj, że użycie masy atomowej daje średnią dla typowej próbki. Próbka bromu ma liczbę masową około 80, ale jak widać, pojedynczy atom bromu prawie zawsze ma liczbę masową 79 lub 81.
 Oblicz liczbę neutronów. Teraz wiesz, że liczba atomowa = liczba protonów, a liczba masowa = liczba protonów + liczba neutronów. Aby dowiedzieć się, ile neutronów znajduje się w elemencie, musisz odjąć liczbę atomową od liczby masowej. Oto kilka przykładów:
Oblicz liczbę neutronów. Teraz wiesz, że liczba atomowa = liczba protonów, a liczba masowa = liczba protonów + liczba neutronów. Aby dowiedzieć się, ile neutronów znajduje się w elemencie, musisz odjąć liczbę atomową od liczby masowej. Oto kilka przykładów: - Pojedynczy atom helu (He) ma liczbę masową 4 i liczbę atomową 2. Dlatego musi wynosić 4 - 2 = 2 neutrony mieć.
- Próbka srebra (Ag) ma liczbę masową około 108 (zgodnie z układem okresowym) i liczbę atomową 47. Średnio każdy atom srebra w próbce ma 108 - 47 = 61 neutrony.
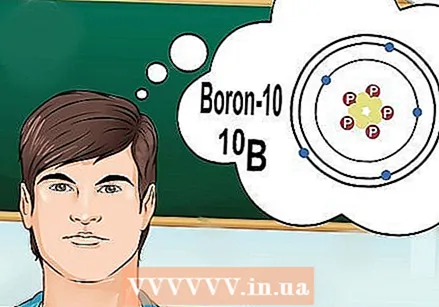 Zrozum, czym są izotopy. Izotop to określony kształt pierwiastka z określoną liczbą neutronów. Kiedy pytanie chemiczne odnosi się do „boru-10” lub „B”, odnosi się do pierwiastka boru o liczbie masowej 10. Użyj tej liczby masowej zamiast „typowej” wartości boru.
Zrozum, czym są izotopy. Izotop to określony kształt pierwiastka z określoną liczbą neutronów. Kiedy pytanie chemiczne odnosi się do „boru-10” lub „B”, odnosi się do pierwiastka boru o liczbie masowej 10. Użyj tej liczby masowej zamiast „typowej” wartości boru. - Izotopy nie mają innej liczby atomowej. Każdy izotop pierwiastka ma taką samą liczbę protonów.
Porady
- Niektóre cięższe pierwiastki mają masę atomową zawartą w nawiasach. Oznacza to, że masa atomowa jest dokładną masą najbardziej stabilnego izotopu, a nie średnią wielu izotopów. (Nie ma to wpływu na liczbę atomową pierwiastka).